生物可吸收支架是治疗血管狭窄等心脑血管疾病的新一代血管植入物,其优势在于满足血管修复的需求后,可随时间推移被组织吸收。然而对于生物可吸收支架在体降解特征与降解引起的血管生物力学微环境变化与血管之间的相互作用目前尚不清楚。
2022年2月,重庆大学的王贵学教授、王亚洲教授和尹铁英副教授团队在Bioactive Materials (IF: 14.593,JCR Q1)杂志发表了题为“Two-stage degradation and novel functional endothelium characteristics of a 3-D printed bioresorbable scaffold”的研究论文,通过SD大鼠腹主动脉植入3-D打印聚乳酸血管支架,在12个月的时间内对支架降解的关键时间节点、血管的组织响应及其病理生理过程进行研究,揭示了3-D打印生物可吸收支架的降解特性及其促进功能性新生内皮修复的机制。

本研究主要揭示了聚乳酸生物可吸收血管支架在植入大鼠体内后的降解分为两个迥异的阶段,相较于金属裸支架,血管功能在恢复的同时,内膜增生较低。研究发现,植入后6个月之前通过增强内皮细胞黏附、内皮紧密连接恢复促进了血管内膜修复;植入6个月之后,降解显著,内膜增生降低、血流动力学逐渐恢复、弹性纤维表达增强。基于此,作者提出聚乳酸生物可吸收血管支架具有“Two-Stage”降解特性(见下图),主要研究内容结果如下。
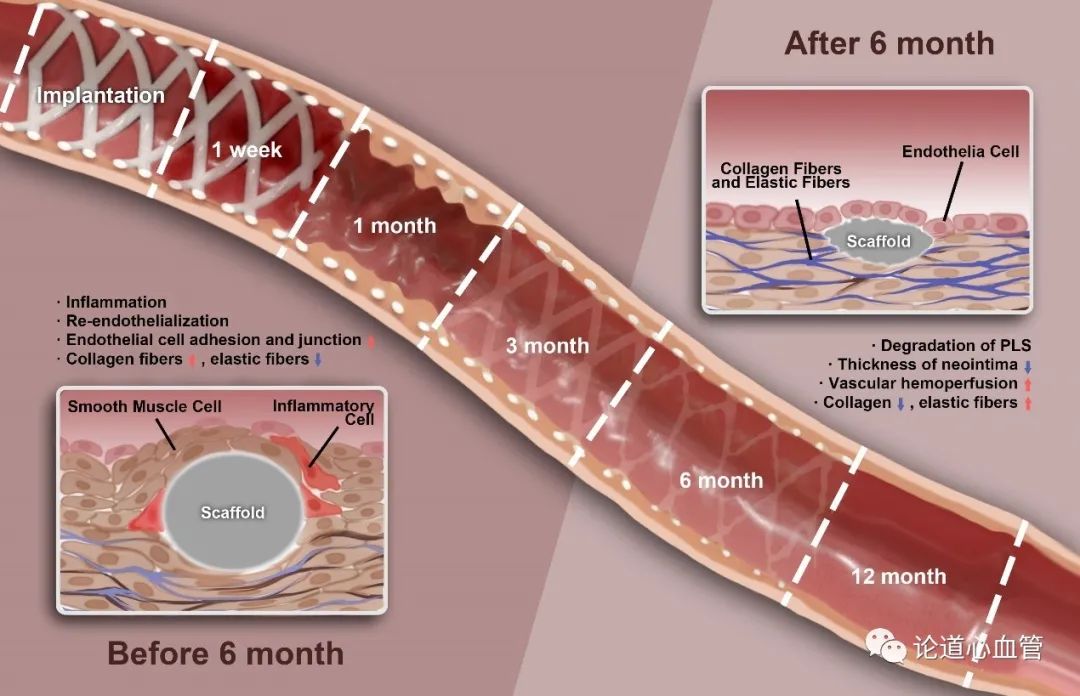
首先,作者发现,聚乳酸生物可吸收血管支架植入SD大鼠腹主动脉后,新生内皮在1个月时即表现出良好的屏障功能,显著高于对照金属支架。免疫荧光染色也提示血管内膜紧密连接蛋白在聚乳酸生物可吸收血管支架植入后表达量逐渐上调,意味着以内膜屏障功能为代表的血管内膜功能逐渐恢复。
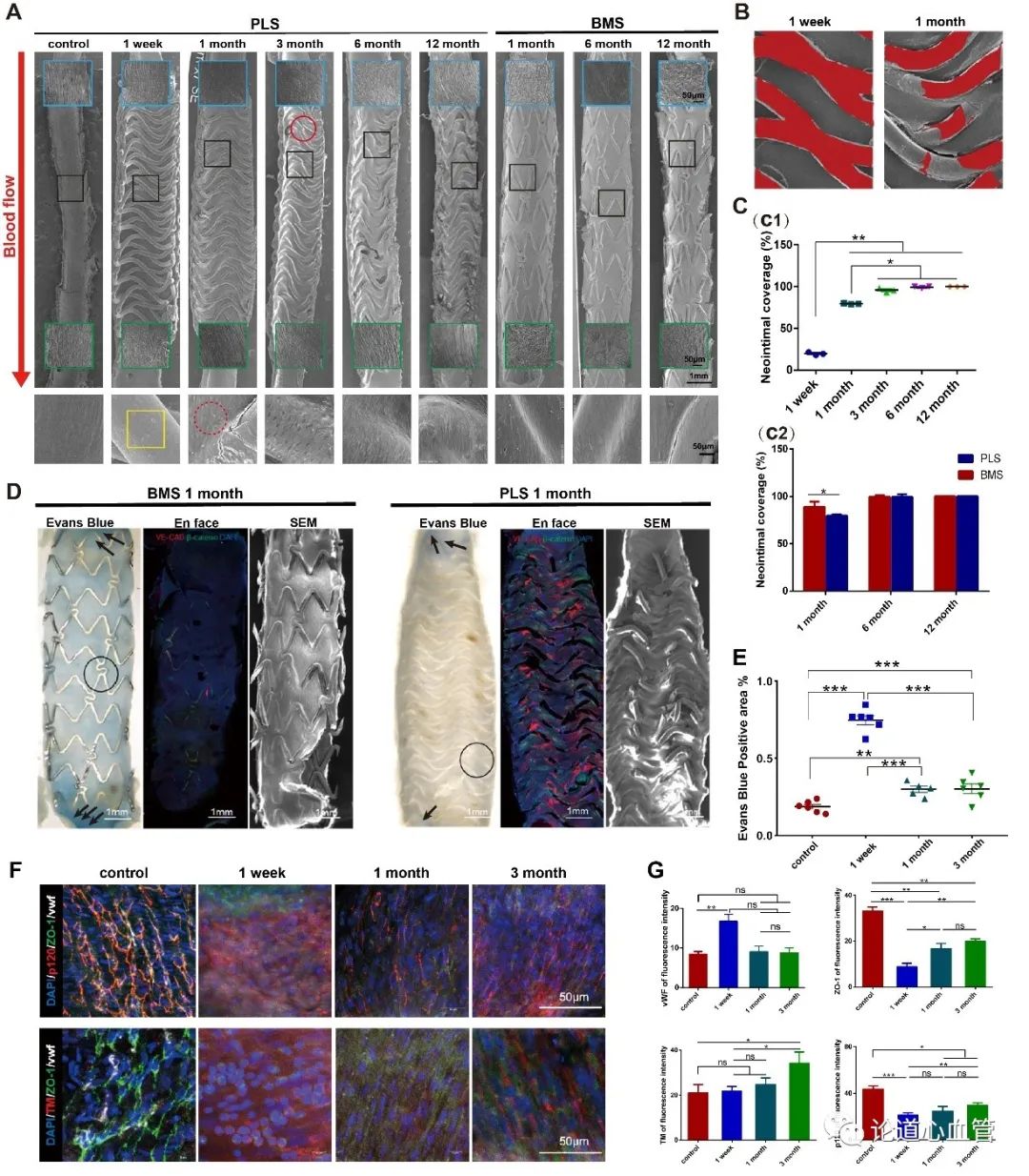
聚乳酸生物可吸收血管支架植入大鼠腹主动脉后,支架丝的显著降解始于植入后6个月,伴随着支架的显著降解,支架段及其近、远心端力学环境发生显著改变。特别是在12个月时近、远心端不同胶原沉积,进一步佐证了血管组织对降解引起的力学环境动态变化有显著的响应,同时也对支架的降解产生影响,而使支架远心端的降解明显强于近心端。